Por: Izabel Guerra e Lucas Venturini (doutorandos IBA/FMRP-USP)
Editora: Luciana Benevides
As altas taxas de mortalidade de pacientes com câncer está associado com a recorrência do tumor para um tecido distante (metástase). Após o tratamento bem-sucedido do tumor primário, as células cancerígenas que se disseminaram para outros locais podem ficar em um estado de dormência, permanecendo viáveis, mas não proliferando1. Pouco se sabe sobre o que pode desencadear esse despertar do câncer, no entanto, estudos sugerem que a inflamação está ligada a um maior risco de recidiva do câncer de mama após um período de dormência clínica. Dessa forma, células inflamatórias, como os neutrófilos, podem fornecer muitos sinais promovendo a progressão da doença. Um dos mecanismos bem conhecidos que os neutrófilos utilizam para matar os microorganismos é a liberação de NETs (Neutrophil Extracelular Traps) no espaço extracelular. Essas NETs, e suas proteases como elastase (NE) e metaloproteinase de matriz 9 (MMP9)3, também podem promover as metástases.
Em seu trabalho Albrengues e colaboradores (2018)4 tiveram como objetivo elucidar como as NETs e suas estruturas estão envolvidas no despertar das células tumorais metastáticas. Os resultados demonstraram que a manutenção da inflamação pulmonar induzida por exposição à fumaça de tabaco ou instilação nasal de doses de LPS, foi capaz de converter as células cancerígenas quiescentes para um estado de formação de metástase com alta capacidade proliferativa. Esses modelos também proporcionaram o recrutamento de neutrófilos para o tecido pulmonar bem como a formação de NETs por essas células. De maneira interessante, quando a formação das NETs foi inibida ou degradada as células tumorais perderam a sua capacidade proliferativa. Ademais, observou-se que o efeito de proliferação tumoral induzido pelas NETs estava associada a ação das proteases, a NE e a MMP9, que se ligavam a proteína da laminina presente na matrix extracelular acarretando a clivagem seqüencial da mesma. Esse remodelamento proteolítico da laminina, mediada pelas NETs, gerou um novo epítopo capaz de ativar a proliferação de células tumorais dormentes através da ativação das integrinas. Para elucidar este fato, foram desenvolvidos anticorpos quiméricos específicos para o epítopo da laminina clivada, e a utilização de um anticorpo anti-laminina foi capaz de prevenir ou reduzir a indução do despertar e a proliferação destas células tumorais após a exposição à fumaça do tabaco ou LPS, uma vez que por competição, o anticorpo impediu a ligação da integrina a laminina e como consequência, a célula tumoral permaneceu em estado de dormência (Figura 1).
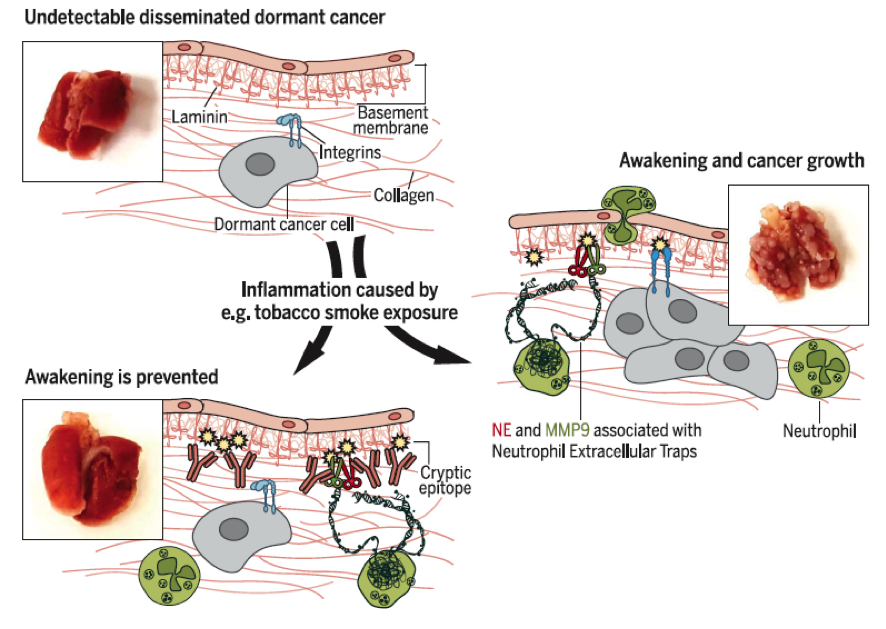
Figura 1: A formação de NETs durante a inflamação pulmonar despertam células tumorais adormecidas. A inflamação pulmonar - causada, por exemplo, pela exposição à fumaça do tabaco - leva à formação de NET. Duas proteases presentes nas NETs clivam sequencialmente a proteína laminina da matriz extracelular. Essa clivagem gera um epítopo que ativa a sinalização e a proliferação de integrinas das células cancerosas anteriormente inativas. A utilização de anticorpos que bloqueiam o epítopo da laminina gerada pelas NETs previnem o despertar das células tumorais induzido pela inflamação.
Referências
- M. S. Sosa, P. Bragado, J. A. Aguirre-Ghiso, Mechanisms of disseminated cancer cell dormancy: An awakening field. Nat. Rev. Cancer 14, 611–622 (2014). doi: 10.1038/nrc3793; pmid: 25118602.
- J. M. De Cock et al., Inflammation Triggers Zeb1-Dependent Escape from Tumor Latency. Cancer Res. 76, 6778–6784 (2016). doi: 10.1158/0008-5472.CAN-16-0608; pmid: 27530323.
- J. Cools-Lartigue et al., Neutrophil extracellular traps s equester circulating tumor cells and promote metastasis. J. Clin. Invest. 123, 3446–3458 (2013). doi: 10.1172/JCI67484; pmid: 23863628.
- J Albrengues et al. Neutrophil extracellular traps produced during inflammation awaken dormant cancer cells in mice. Science. 361, 6409, 4227(2018). DOI: 10.1126/science.aao4227; pmid: 30262472.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










