Autores: Letícia de Aquino Penteado e Mèdéton Mahoussi Michaël Boko
Editado por: Isabel Kinney de Miranda Santos
Referência:
Guo H, Wang Q, Ghneim K, Wang L, Rampanelli E, Holley-Guthrie E, et al. Multi-omics analyses reveal that HIV-1 alters CD4 + T cell immunometabolism to fuel virus replication. Nat Immunol (2021) 22(4):423-433. 10.1038/s41590-021-00898-1
Vírus são parasitas intracelulares obrigatórios que dependem da maquinaria metabólica da célula do hospedeiro para replicação e manutenção do ciclo viral1. Já é sabido que a replicação do HIV em linfócitos TCD4+ depende das vias da fosforilação oxidativa (OXPHOS) e da glicólise2,3, no entanto, pouco se sabe sobre a capacidade do vírus de ativá-las diretamente. Nesse sentido, Guo e colaboradores demonstram que o HIV é capaz de modular o metabolismo celular diretamente para favorecer o ciclo viral levando à patogênese da AIDS4, trazendo valiosas contribuições não só para o entendimento da reprogramação metabólica de linfócitos TCD4+ pelo HIV e apontando alvos para intervenção farmacológica que possa colaborar com a terapia antiretrovial e promover o controle da infecção.
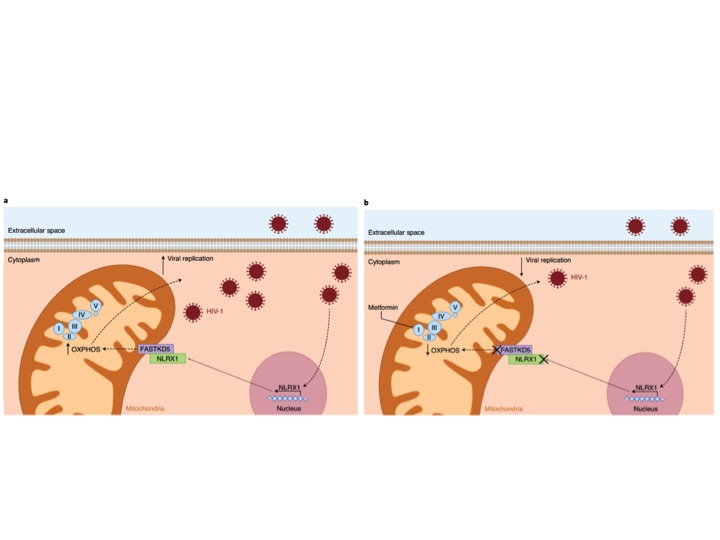
Os pesquisadores analisaram diversos aspectos do estudo de coorte RV2175 de pacientes do leste da África e do sudeste asiático e observaram que não havia diferença na carga viral sanguínea entre os pacientes dessas diferentes regiões, parâmetro importante para evitar fatores confundidores nas análises empreendidas em seguida pelos pesquisadores. A análise do transcriptoma de linfócitos TCD4 revelou uma correlação positiva entre a via da OXPHOS e a magnitude da carga viral. Utilizando, então, os inibidores farmacológicos rotenona e antimicina A e o fármaco metformina, já largamente utilizado para o tratamento de diabetes do tipo II, os autores investigaram se a OXPHOS estava diretamente relacionada à replicação viral. Esses fármacos levaram a uma inibição considerável da replicação viral em culturas primárias de células TCD4+ humanas, bem como da respiração mitocondrial dessas células. Diante desse resultado, os autores então reconstituiram camundongos imunodeficientes NOD-Rag1null IL2rgnull (NRG) com células T CD4+ humanas e os trataram com metformina um dia antes da infecção por HIV. Como consequência desse tratamento, os animais apresentaram menor viremia e menos depleção de linfócitos TCD4+. Esse resultado, por si, tem um enorme impacto clínico porque reposiciona a metformina no arsenal farmacológico, agora como terapia antiretroviral para evitar a depleção de linfócitos T, o que sabidamente leva à progressão para a AIDS. Em seguida, os pesquisadores elucidaram a via molecular empregada pelo vírus para induzir a expressão de OXPHOS nas células T CD4+. Foi observada, no estudo RV217, uma correlação positiva entre a expressão de NLRX1, que codifica um receptor da família NOD-like localizado na mitocôndria e a carga viral. De fato, a infecção viral in vitro aumentou a expressão de NLRX1 e o silenciamento da expressão de NLRX1 por shRNA em células Jurkat reduziu a expressão de genes envolvidos na OXPHOS e a taxa de consumo de oxigênio. Além disso, o silenciamento de NLRX1 em camundongos NRG reconstituídos com células T CD4+ humanas resultou em uma menor carga viral e menor depleção desses linfócitos. Para identificar o mecanismo por meio do qual o receptor NLRX1 regula o metabolismo celular durante a infecção pelo HIV, os autores avaliaram sua interação com outras proteínas mitocondriais. Em condições homeostáticas, foi observado uma interação com a proteína FASTKD5 que aumentou durante a infecção com HIV. O silenciamento de FASTKD5 em células Jurkat suprimiu a replicação viral e reduziu de componentes da cadeia transportadora de elétrons. Dessa maneira, Guo e colegas trazem contribuições valiosas para o entendimento do mecanismo molecular envolvendo NRLX1 e FASTKD5 utilizado pelo HIV para induzir a OXPHOS em células TCD4+ e favorecer a replicação viral. Além disso, o artigo também é de grande relevância clínica, apontando a inibição da OXPHOS como um possível alvo terapêutico conjuntamente com a terapia antiretroviral.
- Sanchez EL, Lagunoff M. Viral activation of cellular metabolism. Virology. 2015;479-480:609–618. doi: 10.1016/j.virol.2015.02.038.
- Clerc I, Abba Moussa D, Vahlas Z, Tardito S, Oburoglu L, Hope TJ, et al. Entry of glucose- and glutamine-derived carbons into the citric acid cycle supports early steps of HIV-1 infection in CD4 T cells. Nat Metab (2019) 1:717–30. 10.1038/s42255-019-0084-1
- Valle-Casuso JC, Angin M, Volant S, Passaes C, Monceaux V, Mikhailova A, et al. Cellular Metabolism Is a Major Determinant of HIV-1 Reservoir Seeding in CD4+ T Cells and Offers an Opportunity to Tackle Infection. Cell Metab (2019) 29(3):611–626.e5. 10.1016/j.cmet.2018.11.015
- Guo H, Wang Q, Ghneim K, Wang L, Rampanelli E, Holley-Guthrie E, et al. Multi-omics analyses reveal that HIV-1 alters CD4 + T cell immunometabolism to fuel virus replication. Nat Immunol (2021) 22(4):423-433. 10.1038/s41590-021-00898-1
- Robb M.L. Prospective study of acute HIV-1 infection in adults in East Africa and Thailand. N. Engl. J. Med. 2016;374(22):2120–2130.
- Day EA, O'Neill L. Targeting mitochondria to beat HIV-1. Nat Immunol (2021) 22(4):398-399. 10.1038/s41590-021-00881.



- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Evento
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Homenagem
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- Immuno2025
- Immuno2026
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- INCT Imuno
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










