Por: Camila Oliveira Silva Souza e Timna Varela (doutorandas IBA/FMRP-USP)
Editora: Luciana Benevides
Diversos estímulos endógenos ou exógenos são aptos em ativar as células do sistema imune e desencadear programas de morte celular. Dentre esses programas de morte temos a apoptose (1). As células em apoptose precisam ser definitivamente eliminadas pelo organismo para que ocorra a restauração das condições homeostáticas. O processo de ingestão de células apoptóticas é denominado eferocitose, palavra oriunda do latim "eferre" que significa "levar corpos ao túmulo" (2). Esse processo é mediado pela liberação de mediadores anti-inflamatórios como: TGF-beta, IL-10 e PGE2, e consequente inibição dos mediadores pró-inflamatórios IL-8, TNF-alpha e GM-CSF (3). Alguns destes mediadores pró resolutivos estão associados a amplificação da resposta imune adaptativa do perfil Th17, como a PGE2. Infecções por Citrobacter rodentium levam a apoptose de células epiteliais e aumento da produção de IL-17 por células T CD4+ (4). Neste contexto, DEJANI et al., 2018 (5) demonstraram o potencial do eixo PGE2-EP4 em inibir as células T CD4+ IL-17+ durante o processo de eferocitose de células apoptóticas infectadas por Escherichia coli (IAC).
De fato, o sobrenadante das células em eferocitose em contato com células dendríticas derivadas de monócitos (BMDCs) promoveu o aumento dos níveis séricos de PGE2, TGF-beta e IL-23, citocinas que auxiliam a diferenciação de células T naives em células do perfil Th17. Assim, a PGE2 gerada durante a eferocitose foi capaz em sinalizar via receptor EP4 presente na superfície das células TCD4+ desencadeando a ativação de cAMP e PKA e consequentemente uma falha na fosforilação de STAT-3 e a diminuição da produção de IL-17 por estas células (Figura 1). Corroborando com estes dados, animais infectados por C. rodentium tratados com inibidor da ciclooxigenase-2 (COX-2) e antagonista do receptor EP4 apresentaram uma diminuição nos níveis de PGE2 seguido de um aumento expressivo de células T CD4+IL-17+ no cólon, além de uma menor perda de peso e um aumento da espessura do cólon quando comparado aos animais veículos – infectados. Deste modo, a ausência de células TCD4+ produtoras de IL-17 levou a melhora da reposta inflamatória durante a infecção. Assim, este trabalho nos traz a luz um o novo papel para a PGE2 durante processos de resolução da inflamação e homeostase.
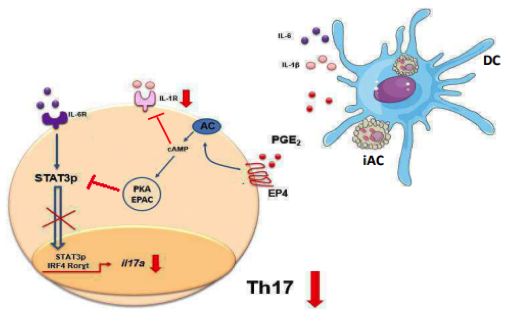
Figura 1. PGE2 proveniente da eferocitose de células infectadas inibe a produção de IL-17 em modelo de infecção intestinal. A PGE2 oriunda da eferocitose de células infectadas atua através do receptor EP4 presente na membrana de linfócitos T CD4+ naives. Esta sinalização leva a ativação de cAMP e inibição do receptor IL-1R simultaneamente, além de induzir a ativação de PKA que é apta em inibir a fosforilação do fator de transição STAT3 e consequentemente a inibição dos transcritos para IL-17, prejudicando assim a resposta linfocitária do perfil Th17 durante a infecção experimental por C. rodentium. (Imagem adaptada (6) (“orlando_ab_me_arafcf_par.pdf”, [s.d.])).
Referências
- GALLUZZI, L. et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation, v. 25, n. 3, p. 486–541, mar. 2018.
- MARTINS, I. et al. Entosis: The emerging face of non-cell-autonomous type IV programmed death. Biomedical Journal, v. 40, n. 3, p. 133–140, jun. 2017.
- FADOK, V. A. et al. Macrophages that have ingested apoptotic cells in vitro inhibit proinflammatory cytokine production through autocrine/paracrine mechanisms involving TGF-beta, PGE2, and PAF. The Journal of Clinical Investigation, v. 101, n. 4, p. 890–898, 15 fev. 1998.
- TORCHINSKY, M. B. et al. Innate immune recognition of infected apoptotic cells directs T(H)17 cell differentiation. Nature, v. 458, n. 7234, p. 78–82, 5 mar. 2009.
- DEJANI, N. N. et al. Intestinal host defense outcome is dictated by PGE2 production during efferocytosis of infected cells. Proceedings of the National Academy of Sciences of the United States of America, v. 115, n. 36, p. E8469–E8478, 04 2018.
- orlando_ab_me_arafcf_par.pdf. , [s.d.]. Disponível em:<https://repositorio.unesp.br/bitstream/handle/11449/154350/orlando_ab_me_arafcf_par.pdf?sequence=3&isAllowed=y>. Acesso em: 27 set. 2018.
- Apaixonados por Imunologia
- Comunicado
- Conteúdo Publicitário
- Curso
- Dept. Imunologia Clínica
- Dia da Imunologia
- Dia Internacional da Imunologia
- Divulgação científica
- Edital
- Especial
- Especial Dia da Imunologia
- Especial Doença de Chagas
- Eventos
- Exposição COVID-19 da SBI
- História da Imunologia no Brasil
- Immuno 2018
- Immuno2019
- Immuno2021
- Immuno2022
- Immuno2023
- IMMUNOLAC
- Immunometabolism2022
- Imune
- Imune - o podcast da SBI
- ImunoWebinar
- Institucional
- IUIS
- Luto
- NeuroImmunology 2024
- Nota
- Nota Técnica
- Notícia
- o podcast da SBI
- Oportunidades
- Outros
- Parecer Científico
- Pesquisa
- Pint of Science 2019
- Pint of Science 2020
- Política Científica
- Sars-CoV-2
- SBI 50 ANOS
- SBI.ImunoTalks
- Sem categoria
- Simpósio
- SNCT 2020
- SNCT 2022
- Webinar
- WORKSHOP
.png)










